|
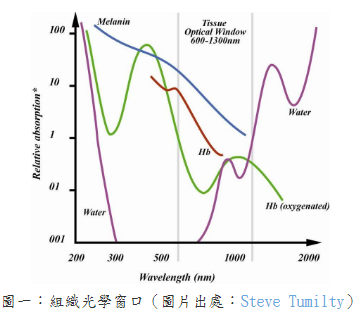
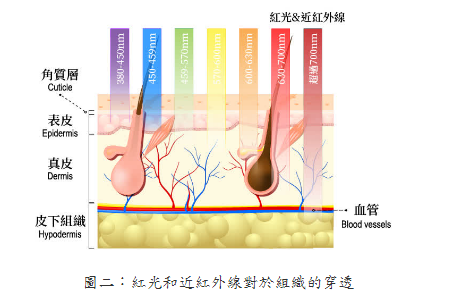
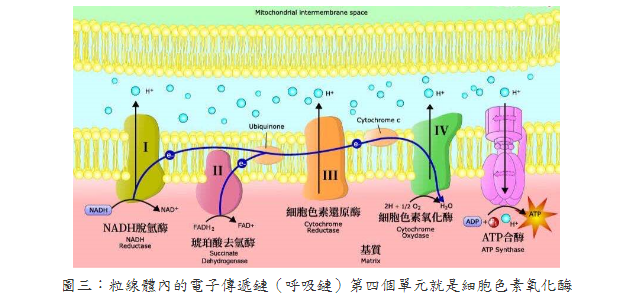
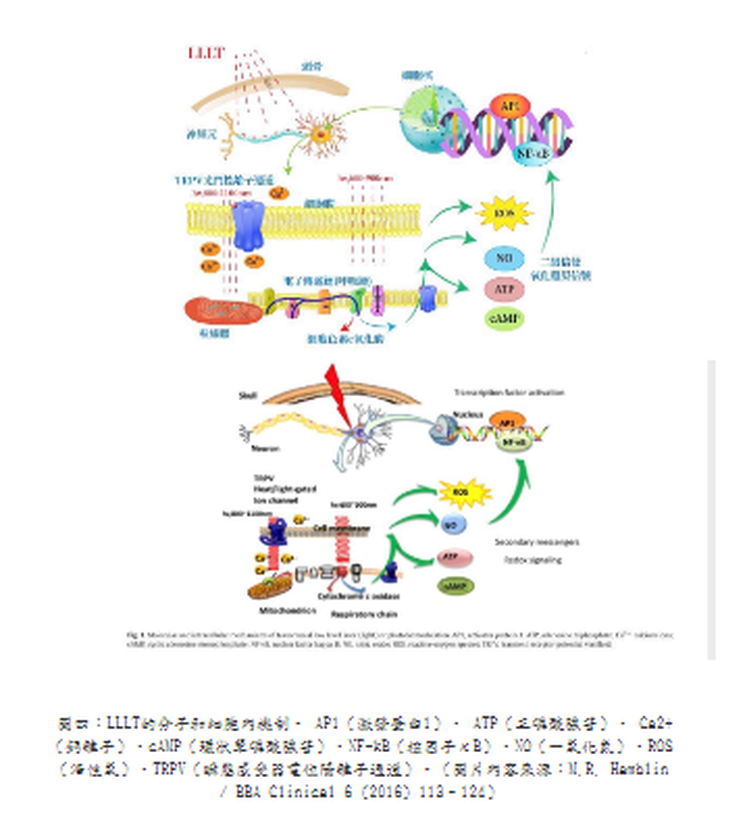
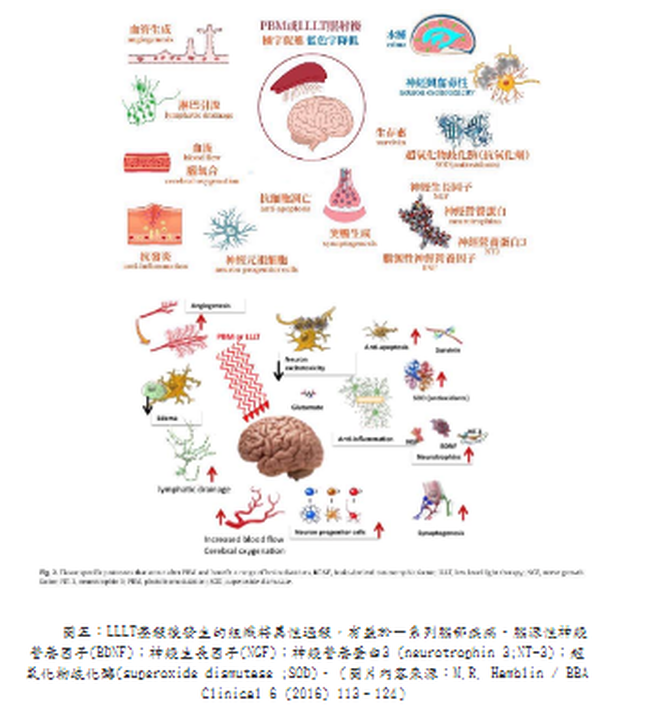
整理報導 LLLT也稱為光生物調節(PhotoBioModulation; PBM),是將低功率雷射或發光二極體(LED)應用於人體以達到治療目的。當將LLLT應用於大腦時,它被稱為經顱LLLT(tLLLT)或經顱PBM (tPBM)[1]。tLLLT自1967年以來一直存在,現在有超過千項的科學研究表明,它可以幫助治療多種疾病而沒有任何有害作用。相反的,這些光子能刺激生物反應並促進細胞正常運行[2~4]。更幸運的是,使用紅光和近紅外線tLLLT在家中進行自我治療變得非常容易。 在波長632~1064奈米(nm)之間的紅光和近紅外線會產生積極的生物學效果。對於腦細胞,最佳範圍似乎在800 nm至1000 nm之間,因為這些波長可以穿透頭皮和頭骨並到達大腦[5~13]。這些光會刺激細胞內的光化學反應,從而加速自然癒合過程並引起行為的有益變化[14]。它是如何做到的?主要是透過活化你的粒線體。 LLLT影響粒線體呼吸並促進包括神經組織在內的多種組織的有益細胞功能。大腦的光生物調節作用於細胞色素C氧化酶(CCO)的光子作用,從而導致血液動力學效應。粒線體被認為是“細胞的動力源”,它以5'-三磷酸腺苷(ATP)的形式在體內產生大部分能量。 ATP是你身體中細胞燃料的主要來源。你一直在使用它,你的大腦也需要足夠的它才能正常運作。良好的粒線體功能和ATP的產生對於神經保護、認知增強以及預防和緩解多種神經系統和精神疾病至關重要[15]。 tLLLT支持粒線體功能並顯著增加大腦中ATP的產生([14,16~29]。粒線體包含光感受器,這些光感受器吸收光中的光子並將其轉換為ATP,即可以用來執行細胞任務和生物過程的能量[30,31]。這個過程可與植物的光合作用相媲美,在此期間,陽光被植物吸收並轉化為能量供植物生長[32,33]。通過刺激粒線體並產生更多的ATP,tLLLT可使腦細胞獲得更多的ATP能量,從而更好地運作並進行自我修復。 在紅光LLLT治療期間,紅光和近紅外線被細胞內的發色團吸收,體內的各種細胞和組織類型具有其獨特的光吸收特性,對不同波長有不同的反應。因此,紅光和近紅外線搭配使用,可以為身體的細胞和組織提供更大範圍的好處。 光生物學的第一定律指出,低功率可見光對活體生物系統要能產生影響時,光子必須被屬於某些分子發色團或光受體的電子吸收帶吸收[34]。找到該發色團的身份的其中一種方法是完成作用光譜(action spectrum)。這是代表生物光響應的圖,其為波長、頻率或光子能量的函數,且應該類似於光感受器分子的吸收光譜。結構化的作用光譜可以被構建的事實支持了這個假設:由光刺激細胞光受體和信號傳導途徑的存在。 第二個重要的考慮因素涉及組織的光學特性。組織中光的吸收和散射都是取決於波長,主要組織發色團(血紅蛋白)在短於600奈米(nm)的波長處具有高吸收帶。在波長大於1150nm時,水開始顯著吸收。由於這些原因,在組織中存在所謂的“組織光學窗口(tissue optical window)”,其中紅光和近紅外線波長的有效組織穿透是最大的(圖一)。因此,儘管藍色、綠色和黃色光可能對光學透明培養基中生長的細胞具有影響,但LLLT在動物和人類患者中的使用幾乎完全涉及紅光和NIR(600-950nm)。 紅光的好處:紅光波長在630-700 nm之間,這是穿透皮膚細胞和皮脂腺的理想波長,有利於皮膚紋理和膚色,能撫平細紋、促進膠原蛋白生成,並使皮膚恢復活力。 在圖二中,你可以看到波長630以上的紅光和近紅外線波長比光譜中的任何其他波長穿透的更深。 安全且無痛的治療: 紅光LLLT與其他基於光的療法不同,因為它可以促進有益的癒合而不會對身體造成傷害。與高強度的脈衝光或雷射光通過對外層造成控治性傷害以刺激膠原蛋白(collagen)再生來改善皮膚外觀不同,紅光和近紅外線穿透皮膚表面,刺激深層癒合和細胞再生,而不會傷害外表皮。治療期間沒有疼痛、發熱或不舒服的感覺。此外,紅光LLLT至今尚未有明顯副作用的報導。 紅光LLLT恢復細胞健康:所有癒合的基礎: 紅光LLLT最顯著的好處是它對身體細胞的影響,當我們的細胞以最佳效率或接近最佳效率作用時,對健康的益處是數不盡的。紅光LLLT對細胞的最關鍵功能之一是刺激膠原蛋白的產生。 膠原蛋白是體內最常見的蛋白質,佔皮膚(我們最大的器官)蛋白質的70%、體內蛋白質的30%。膠原蛋白可強化頭髮與結締組織的健康,並為使肌膚緊緻和彈性。隨著年齡的增長,膠原蛋白的產生減少,導致皮膚變薄、鬆弛,造成皺紋增加。而紅光LLLT恢復細胞功能,使膠原蛋白的產生也增加。 紅光LLLT益處的臨床報告 紅光LLLT具有悠久的歷史和強有力的科學證據,並且包括老年人在內的多數患者都能接受這樣的治療。此外,治療的副作用很少。 LLLT所展現的具體效果如下 減肥和減脂 紅光LLLT療法不僅讓身體更有活力,研究人員還發現紅光LLLT會影響脂肪細胞(adipocytes),導致脂質(lipids)分散。換句話說,光療有助於身體除去脂肪細胞[37]。 近年來,在許多臨床試驗中已經看到紅光LLLT對降低脂肪、脂肪團和肥胖控制的積極作用。而且其與許多促進減肥的解決方案(例如藥物和手術)不同,紅光LLLT療法是一種安全、自然且無創的選擇,可以使身材更好、更健康。 發表於2011年“Journal of Obesity Surgery”的一項研究,進行了紅光治療身體輪廓的實驗。這項雙盲隨機研究對參與者進行了為期4週的光療,波長為635-680nm,並記錄了對腰圍尺寸的影響。在研究結束時,參與者在腰圍周長方面取得了統計學上的顯著減少[38]。 在2015年進行的一項研究評估了光療和運動對64名年齡在20至40歲的肥胖女性的影響。其中一組運動並接受紅光治療,而對照組只從事運動,他們得出的結論是,紅光LLLT和運動一起進行比單獨從事運動對減少脂肪更有效。研究人員還觀察到紅光LLLT和運動的組別,其骨骼肌質量有明顯的增加[39]。在2018年發表的一項對於肥胖年輕女性的研究中發現了類似的結果,實驗組遵循運動方案且結合紅光LLLT,而對照組則僅僅執行運動方案,進行運動和紅光LLLT的女性在脂肪量和胰島素變量方面發生了更顯著的變化[40]。 防止脫髮並刺激頭髮生長 [41~43] 脫髮(Alopecia)或掉髮是一種常見疾病,影響50%的40歲以上的男性和75%的65歲以上的女性,很少有被證實的有效治療方法。然而,研究表明,紅光LLLT可以刺激頭髮生長,紅光波長已被公認能刺激毛囊中的表皮幹細胞,將毛囊轉移到毛髮生長期(頭髮活躍生長的階段)。 幫助睡眠[44] 紅光是一種強而有力的睡眠促進因素,與綠光形成鮮明對比。有證據表明,這種形式的光在600-900nm的波長範圍內會誘導體內產生褪黑激素。褪黑激素是一種誘導睡眠的賀爾蒙,它是最根本的助眠劑,在紅光的照射下可以增加它的分泌產量。使用紅光在夜間入睡有一個額外的好處:在紅光光譜的遠端,紅外線已被證明可以促進癒合並促進線粒體(能量產生細胞)的再生,從而促進長期能量使用的改善。 幫助老人失智症 近期的研究[45~47]表明,紅光LLLT在幫助患有老人癡呆症和阿茲海默症等疾病的精神衰退患者方面有著驚人的希望,由於LLLT既能減輕炎症反應,又能改善充氧作用(oxygenation)和血流量,因此治療後大腦功能有可能得到顯著改善。研究表明,在患有輕度和中度癡呆症且接受LLLT的患者中,認知、睡眠和心智功能得到了真正的改善,減少了焦慮,爆怒和徘徊。 減少發炎[48] 近紅外線藉由降低炎症標記物的存在來減少體內的整體發炎,這種炎症減少可以幫助緩解與關節疼痛、肌肉酸痛、自身免疫疾病、關節炎、創傷性腦損傷和脊髓損傷相關的症狀。 減輕疼痛 在一項臨床研究[49]中,脊髓損傷引起的神經性疼痛可透過應用紅光LLLT治療有顯著減少,進行這項研究的科學家稱之為“具有重要臨床意義且激勵人心的前景。”近紅外線藉由緩解關節的僵硬和酸痛、減輕發炎、緩解肌肉痙攣和增強血液流動來達到減輕整體的疼痛。 減少訓練和受傷後的恢復時間[50] 對於高性能運動員(以及像他們一樣訓練的運動員),紅光療法可以幫助加速疲勞和受傷後的肌肉修復,細胞內的線粒體對紅光療法特別敏感,肌肉細胞特別富含線粒體。另外紅光LLLT可刺激幹細胞,進一步幫助肌肉恢復。 提高生育率和增加睾丸激素濃度 [51] 大約30歲時,雄性睾丸激素濃度自然地開始下降。男性希望通過紅光LLLT獲得性衝動、性滿足感、生育能力和身體表現的自然提升,紅光和近紅外線可以刺激睾丸中的光感受器蛋白,從而導致更高的睾固酮產生。其他研究推測,紅光LLLT可能會影響大腦中的松果腺體,這對生殖有重要影響。 由於膠原蛋白的產生增加,皮膚看起來更健康更飽滿[52] 紅光LLLT對皮膚狀況的改善有顯著的幫助,紅光波長特別針對皮膚細胞內的線粒體發色團產生膠原蛋白,與僅重塑皮膚外層相比,膠原蛋白刺激對皮膚產生更全面和持久的好處。幹細胞也可以被激活,增加組織修復,結果是加速癒合和傷口修復,改善增生性疤痕的外觀、減少細紋和皺紋,以及改善皮膚紋理。一項研究的參與者經歷了臨床評估的皮膚膚色和膠原蛋白密度的改善。 改善血液循環(改善血液流動)[53] 在許多研究中,臨床證明紅光LLLT可以增加血管直徑並改善血液循環,此外,紅光LLLT還可以保護紅血球免受氧化應激,並限制外科手術過程中的血小板損失。 細胞色素c氧化酶(cytochrome c oxidase ; CCO): 對LLLT作用機制最深入研究的重點就是細胞色素c氧化酶(cytochrome c oxidase ; CCO),它是粒線體呼吸鏈的第四個單元(如圖三),負責利用葡萄糖代謝所產生的電子將氧氣還原為水[54]。從理論上講,一氧化氮(NO)可能會抑制CCO酶的活性(尤其是在缺氧或受損的細胞中)。這種具抑制性的NO可以被CCO(包含兩個血紅素和兩個擁有不同吸收光譜的銅中心CuA和CuB)所吸收的光子從CCO解離[55]。這些吸收峰主要在紅色(600-700 nm)和近紅外線(760-940 nm)光譜區域。當NO被光離解釋放出時,線粒體膜電位會增加,使更多的氧氣被消耗、更多葡萄糖被代謝,而線粒體會產生更多的ATP。 代謝功能改善是LLLT最容易被察覺的作用之一,而增加的細胞內ATP產生則是最受支持的作用機制之一[56]。此外,一些臨床前研究表明,由於各種腦部疾病,接受LLLT的實驗動物(小鼠或大鼠)的大腦ATP含量明顯增加了[57,58]。普遍認為粒線體功能障礙、ATP供應不足和氧化壓力是幾乎所有形式的腦疾病的促成因素[59]。據研究報導,這涉及神經系統疾病,例如重度憂鬱症、腦外傷、帕金森氏病和AD [60-63]。 活性氧(Reactive oxygen species; ROS)、一氧化氮、血流 研究顯示當粒線體吸收LLLT期間傳遞的光子時,線粒體中產生的活性氧(ROS)會瞬間增加。ROS的爆發可能觸發線粒體信號傳導途徑,從而導致細胞中的細胞保護、抗氧化和抗凋亡(anti-apoptotic)作用[64]。通過光解離作用釋放的NO既可作為血管擴張劑,也可作為淋巴液的擴張劑。此外,NO也是有效的信號分子,可以激發許多有益的細胞途徑[65],圖二說明了這些機制。 LLLT光照後最容易測量的變化之一是腦血流量和氧合的變化。以1064 nm近紅外線來照射志願者的前臂[66],發現隨著時間的推移、光能量劑量的累積,LLLT引起照射部位的CCO濃度(Delta [CCO])和氧化血紅蛋白濃度(Delta [HbO])明顯增加。有人提出,由於LLLT導致的NO釋放是使腦血流量增加的原因[67]。 NO是主要的神經元信號分子,具有觸發血管舒張的能力。 為此,它首先刺激可溶性鳥苷酸環化酶(guanylate cyclase)形成環磷酸鳥苷(cyclic GMP; cGMP),然後cGMP激發蛋白激酶G,導致鈣離子的再攝取和鈣激發鉀通道的開放。隨後鈣離子濃度下降可防止肌球蛋白輕鏈激酶(myosin light-chain kinase)被磷酸化成肌球蛋白分子,進而使血管和淋巴管內壁的平滑肌細胞鬆弛[68]。然後,這種血管舒張促進了血液循環的改善,也改善了大腦氧合。而腦血流量(cerebral blood flow ; CBF)疾病、神經血管功能障礙和較低的大腦氧合水平已被認為是AD的重要特徵[69]。 光敏離子通道和鈣: 除了CCO以外,還必須有其他類型的光感受器,因為某些研究明顯證明即使比上述紅光/近紅外線更長的波長也會產生有益的影響。據報導,諸如980nm[70]、1064nm雷射[71]和1072nm LED [72]等波長,甚至寬帶IR光[74]都具有光生物調變類型的效應。 儘管尚未確定這些波長的光感受器,但目前主要的論點認為是位於熱敏感或光敏感離子通道中的水(或許是奈米結構水)。藉由光介導的鈣離子通道的打開可以用來解釋觀察到的細胞內鈣明顯變化,例如瞬間受器電位(transient receptor potential ; TRP)超家族的成員[73]。TRP描述了一個以瞬間受器電位陽離子通道 (transient receptor potential cation channel, subfamily V, member 1 ;TRPV1為典型的大離子通道家族,最近被確定為是辣椒素(辣椒中的活性成分)的生物受體[75]。TRP通道的生物學作用是多種多樣的,但是許多TRP通道涉及到熱感測和溫度調節[76]。 信號傳導介質和轉錄因子激發: 大多數研究團隊認為,LLLT對大腦的有益作用可以藉由腦血流量的增加、更多的氧氣供應、氧氣消耗、ATP產生和線粒體活性改善來解釋[77,78]。有許多研究表明,短暫的光照(尤其是遭受某種急性損傷或外傷的實驗動物)的效果可能會持續數天、數週甚至數月[79]。光的這種長效作用只能藉由激發導致長時間蛋白質表達變化的信號傳導途徑和轉錄因子來解釋。LLLT對刺激線粒體活性和血流的影響本身無法解釋光照的長期影響。 最近的綜合研究列出了不低於十四種不同的轉錄因子和信號傳導介質,據報導它們在光曝照後會被激發[34]。圖四說明了吸收光子的腦部神經元細胞內兩個最重要的分子感光體或生色團(細胞色素c氧化酶和熱控離子通道)。信號傳導途徑和轉錄因子的激發導致LLLT在大腦中的最終作用。 圖五說明了一些組織特定的機制,這些機制是由圖二中解釋的初始光子吸收效應所引起。緊接著可以發生各種流程效應,這些效應可以使相應範圍的腦部疾病受益。這些效應可分為短期刺激(ATP、血流、淋巴流、腦部氧合、水腫減少)。另一組流程效應則圍繞著神經保護(抗凋亡蛋白的上調、神經興奮毒性降低、抗氧化劑增加、發炎減少),其可以歸為“幫助大腦自我修復”的效應,包含神經營養蛋白(neurotrophins)、神經元生成(neurogenesis)和突觸生成(synaptogenesis)。 神經保護:
各種證據表明LLLT可以用於神經保護,他透過抑制糖原合酶激酶3β (Glycogen synthase kinase 3 beta ; GSK3β)的活性來保護細胞免受損傷,促進其存活和壽命以及逆轉凋亡信號傳導過程,防止細胞凋亡,凋亡是隨著生物體生長而發生的正常細胞死亡。據信GSK3β充當AKT和Bax凋亡基因之間的介體,Bax是一種在促凋亡刺激存在下易位至細胞核以觸發該過程開始的蛋白質。但是,當GSK3β受到抑制時,AKT與AKT之間的通信路徑被切斷。結果,無法表達Bax易位,因此被抑制[80]。 LLLT還以防止衰老的形式表現出神經保護作用[81]。已顯示它可以激發細胞外信號相關激酶(extracellular signal-related kinase ; ERK)/前叉箱蛋白M1(forkhead box protein M1; FOXM1)途徑。FOXM1蛋白調節細胞週期從G1到S期,並且透過激發ERK / FOXM1途徑,LLLT導致ERK向細胞核的轉運更大、FOXM1在核中的積累更大。反過來,這會導致p21蛋白的表達降低以及G1期的有絲分裂停滯,從而減慢了細胞衰老的進程。 LLLT也被證實可有效保護細胞免受毒素傷害[82]。在Eells團隊的研究裡[83]暴露於甲醇的囓齒動物模型中,用670 nm光照成功地使視網膜功能恢復並防止了組織損傷。這可能是由於以下事實:甲醇會生成有毒的代謝產物甲酸(CCO的抑制劑),而LLLT是CCO已知的刺激劑,LLLT的抗毒素作用可以追溯到其對CCO的刺激作用。 此外,LLLT已證明可用不同的方式影響處於不同健康狀態的細胞,本質上是以促進其存活所必需的方式修飾細胞。例如,在正常細胞中,CCO對光的吸收會導致基質金屬蛋白酶(Matrix Metalloproteinase; MMP) 高於基線並導致ROS產生短暫增加。然而,在存在氧化壓力,興奮性毒性或抑制電子傳輸而導致MMP較低的細胞中,光吸收會導致MMP朝正常濃度增加,並降低ROS產生[84]。同樣,健康細胞對LLLT的典型反應是細胞內鈣離子的短暫增加[85]。然而,在已經含有過量鈣離子的細胞中(一種稱為興奮性毒性的現象),LLLT會引發相反的反應,換言之,它會降低細胞鈣的過量濃度,從而促進細胞存活、降低氧化壓力並使MMP恢復至正常水準 [86]。 氧化壓力: 當人體抵抗活性氧作用的能力與活性氧(ROS)產生發生不平衡的狀況時,就會發生氧化壓力,當活性氧過剩,它們會透過抗氧化劑而變得有害。許多研究顯示氧化壓力與各種神經系統疾病相關,例如嚴重的憂鬱症和顱腦外傷,更不用說心血管疾病和阿茲海默症[87-90]。但是,這種情況比起初步觀察要來的複雜得多,因為大量針對這些疾病的抗氧化劑治療臨床試驗都失敗了[91]。顯然,一定水準的氧化壓力對於人類的最佳運作功能是必需的,而透過補充抗氧化劑去除所有氧化壓力可能適得其反[92]。一篇重要的論文表明,服用抗氧化劑時,運動對健康的好處就會消失[93]。 Salehpour團隊 [94]表明,小鼠的睡眠剝奪(SD)會引起海馬的氧化壓力,進而導致記憶障礙。將具有NIR(810nm)的LLLT經顱治療(每天一次,連續3天)遞送至頭部,小鼠在Barnes迷宮和What-Where-Which任務上表現更好,海馬中抗氧化酶濃度增加、氧化壓力生物標誌物降低。在研究LLLT對受創傷肌肉的影響時,證明其可有效調節細胞產生的細胞因子誘導型一氧化氮合酶(cytokine-inducible nitric oxide synthase ; iNOS)的量。這個很重要,因為過量的iNOS會導致NO的過量生成,這將引發ROS / RNS(過氧亞硝酸鹽)的生成增加,從而導致氧化壓力增加。具體而言,LLLT可以減少過氧亞硝酸鹽[95],同時仍保留NO合酶其他亞型的積極作用,例如內皮型一氧化氮合酶(endothelial nitric oxygen synthase ; eNOS),這是主要負責LLLT血管舒張作用的成份[96, 97] 。 LLLT也已顯示出刺激血管生成的增加,從而導致血流的進一步改善。正如Cury [98]所證明的,在780 nm和40J/cm2的LLLT觸發了蛋白HIF1α和血管內皮生長因子表達的增加,以及基質金屬蛋白酶2(matrix metalloproteinase 2)活性的降低,這些都被發現能誘導血管生成。另外,在體外研究紅/近紅外線對紅細胞的影響時,發現近紅外線在保護紅細胞免於氧化方面非常有效[99],氧化是受如嚴重憂鬱症等疾病折磨的大腦中的常見現象[100]。廣泛的線粒體功能障礙、鋁和重金屬含量增加以及AD中發生的神經發炎會產生大量的氧化壓力。氧化壓力導致Aβ沉積,tau蛋白過度磷酸化以及隨後的突觸和神經元喪失[101]。 抗發炎效應: 發炎是先天免疫系統對細菌和病毒等異物的防禦之一,在細胞層級上,它會在轉錄因子(transcription factor) NF-κB被激發時發生。雖然急性發炎是有助於人體的,但慢性發炎就會產生非常不利的影響。許多疾病,包括神經退行性疾病和情緒障礙,可以部分歸因於慢性發炎。LLLT幫助平息發炎的一種方法是抑制環加氧酶2(cyclo-oxygenase 2; COX-2)酶。 Lim研究團隊 [102]發現低功率的635nm光照射能夠通過減少細胞內ROS引起COX-2抑制。目前,廣泛支持利用藥物來抑制COX-2,其中COX-2抑制劑在非類固醇類抗炎藥市場上佔有很大的份額[103],而基本上使用LLLT就可以實現相同的結果。 LLLT還可以調節細胞中游離的NF-κB水平。NF-κB可以被發現在與抑制蛋白IκB結合的細胞質中。促炎性刺激具有激發IκB激酶的能力,激酶是引起IκB降解的上游信號調節劑。IκB降解後,NF-κB可以自由轉運至細胞核,從而觸發促炎基因的表達。有證據表明,LLLT可以對NF-κB產生相反的影響,具體取決於研究的細胞類型及其激發狀態。研究發現在正常的成纖維細胞中,LLLT可以藉由刺激線粒體產生少量ROS來激發NF-κB [104]。然而,同一小組發現在樹突狀細胞(另一種巨噬細胞)中,該細胞已被激發為M1表型,LLLT可以減少促炎細胞因子[105]。同樣,Yamaura團隊發現在接受LLLT的活化類風濕性關節炎滑膜細胞中NF-κB濃度降低了[106]。 另外,LLLT具有調節細胞激素(cytokines)濃度的能力,這些蛋白是免疫系統的重要信號分子。研究顯示LLLT可調節促炎和抗炎細胞激素的濃度,儘管對於減少發炎,其調節腫瘤壞死因子(tumor necrosis factor ;TNF)和其他促炎細胞激素濃度的能力特別有用。應該注意的是,與身體其他部位的發炎相比,大腦內的發炎具有明顯的差異。實際上,“神經發炎(neuroinflammation)” 這個術語通常用於激發小膠質細胞(microglia)。小膠質細胞在中樞神經系統中起免疫防禦系統的作用[107]。小膠質細胞不斷清除中樞神經系統的斑塊,受損的神經元和突觸以及傳染原。 小膠質細胞可以呈現多種表型,並保留改變其功能以維持組織穩態的能力。小膠質細胞可以藉由LPS或IFN-γ激發成表達促炎性細胞因子並能殺死微生物細胞的M1表型。另一方面,小膠質細胞可以被IL-4 / IL-13激發為M2型,以吞噬碎片、消炎和修復組織。越來越多的證據表明,代謝重新編程在先天性發炎反應的調節中起著作用[108]。既然有大量證據表明LLLT可以激發線粒體代謝,使其氧化為磷酸化(oxidative phosphorylation),並且遠離有氧糖酵解,這就是LLLT可能將小膠質細胞表型(microglial phenotype)從M1變為M2的合理原因[109]。這種轉變的結果是LLLT誘導的M2可以代替M1,該M1無法處理AD中的β-澱粉樣斑塊等物質,因此會產生ROS和炎性細胞因子。而LLLT誘導的M2可以清除斑塊,發揮抗炎和抗氧化作用,並促進組織癒合[110]。 神經生成: 多年來,人們一直認為成年大腦無能力生長新的腦細胞。儘管已經認識到,胚胎、幼小動物和兒童大腦的成長和發育必須能夠由神經幹細胞(neural stem cells ; NSC)和神經祖細胞(neuroprogenitor cells)介導的神經發生,儘管這一過程在成年期就已經停止了。我們認識的轉折點是發現了成人的神經生成,並鑑定了在體外和體內均可作為NSC發揮作用,其能產生新的神經元、神經膠質細胞[111]。 Oron等人的一項研究首次報導了通過LLLT刺激腦部神經所發生的神經生成。在2006年,他在大鼠中誘發了中風,並用LLLT治療了它們。當用LLLT治療時,在半球同側腦室下區域新形成的神經元細胞和遷移細胞的數量顯著增加[112]。Xuan團隊研究也發現了類似的結果,他們使用LLLT治療了患有頭部外傷的小鼠[113]。 促進突觸生成(Synaptogenesis): 迄今為止,LLLT對大腦最顯著且潛在的影響之一是其促進突觸生成的能力,也稱為神經可塑性。這個過程至關重要,因為可以將包括頭部外傷、中風、神經退行性疾病和情緒障礙在內的許多大腦狀況部分或全部追溯到大腦某些區域的神經元連接不良或異常。如果LLLT具有通過促進神經組織或重組來抵抗這些作用的能力,那麼它可能被證明是治療這類型腦部疾病的一種新方法。 LLLT促進神經元連接的一種方式可能是藉由上調腦源性神經營養因子(brain derived neurotrophic factor ; BDNF)。BDNF是神經系統中發現的一種蛋白質,有助於維持現有的神經元並促進新神經元和新突觸的生長。據信調節樹突結構可以促進改善的突觸傳遞[114]。LLLT已顯示可通過ERK / CREB (cAMP-response element binding protein; 環磷腺苷效應元件結合蛋白) 途徑減慢BDNF的衰減,從而積極影響樹突形態發生並改善神經元連接性[115]。BDNF也是蛋白synapsin-1的媒介,它通過加速神經元纖維的發育和維持突觸的接觸來改善突觸的形成[116]。Meng團隊[117]進行的一項研究中,在780nm的光照射下,胚胎大鼠的神經組織中觀察到了更緊密的分支和纖維之間的互連性,表明這些蛋白質的活性增強。BDNF也與神經塑性適應的改善有關,這在腦外傷和中風的情況下尤其重要[118]。 如果可以最終證明LLLT刺激人類以及小鼠的神經可塑性和突觸形成,那麼就已經為廣泛人體臨床應用打開了大門[119]。神經可塑性受損或異常可能與多種腦部疾病有關,例如阿滋海默症、精神疾病、中風、頭部外傷和成癮[120-124]。 最重要的是,tLLLT還顯示出: •增加神經生成、腦源性神經營養因子(BDNF)和神經生長因子(NGF)[125~127]。 •減輕發炎[125、126、128、129]。 •減少大腦中的自由基和氧化壓力[130]。 •增加血液流量和血液循環,包括額葉皮層內的血液[131、132、133]。 •通過增加人體的鴉片類藥物(天然鎮痛藥)減輕疼痛[134,135] •額葉皮層耗氧率增加[133,136] •增加血清素[137] 除此之外我們還觀察到: •思維更敏銳 •改善注意力,警覺性 •減少疲勞感 •容易入睡且深層睡眠比例增加 •心率變異(HRV)提升 •內臟脂肪下降 總體的來說,tLLLT改善了整體的身心素質。不會像以前那樣容易疲勞和疲倦,而且可以長時間專注和思考。 tLLLT也具有累積作用。隨著時間的推移,你的大腦會變得越來越強壯,並且更有彈性。tLLLT可以成功治療許多嚴重的腦損傷和精神疾病,包括憂鬱症、焦慮症、創傷後壓力障礙、顱腦外傷、腦震盪症候群、中風和阿茲海默症。 以下將探討tLLLT如何對上述每種疾病都有幫助。 憂鬱症和焦慮症: 在大鼠和人體中進行的研究提供了證據,表明tLLLT治療可以改善情緒並減輕憂鬱症狀。2009年,研究人員對10名有嚴重憂鬱和焦慮史(包括創傷後應激障礙和藥物濫用)的患者進行了研究,並在其額頭上應用了tLLLT治療四個星期。在研究結束時,10名患者中有6例緩解了憂鬱,10名患者中的7例緩解了焦慮。沒有可觀察到的副作用[138]。 考慮到多項研究表明,憂鬱與大腦額葉皮層的異常血流有關,而tLLLT可以增加血流和血液循環,這是有道理的[139,130]。其他研究表明,參與者報告在tLLLT治療後兩週內,積極情緒顯著增加,憂鬱症狀有明顯減輕 [141~143]。由於tLLLT的治療,創傷性腦損傷(TBI)的患者也降低了憂鬱、焦慮、易怒和失眠,生活質量總體得到明顯改善[144,145]。 創傷性腦損傷(Traumatic brain injury; TBI): TBI是一個日益嚴重的健康問題。在美國,估計每年有170萬人維持TBI [146]。輕度TBI(腦震盪)佔所有腦損傷的75%。部署到伊拉克和阿富汗的軍事人員在國外時經常經歷輕度的TBI,返回家鄉後幾個月,他們常常因創傷後壓力障礙(Post-traumatic stress disorder ; PTSD)、憂鬱和焦慮而掙扎[147、148]。研究表明tLLLT可以起到幫助作用[149]。 多項人體研究表明,慢性輕度TBI患者通過tLLLT治療可改善認知,記憶和睡眠。一項研究檢查了tLLLT是否可以幫助11例慢性輕度TBI症狀患者,他們都有認知功能障礙,其中四個有腦震盪。 經過18次tLLLT治療後,他們的認知、記憶和語言學習得到了改善。參與者還說,他們的睡眠更好,並且PTSD症狀更少。同事,朋友和家人報告說,他們的社交,人際交往和職業功能得到改善[150]。如果tLLLT是藥物,我們肯定會聽到它。 在另一項研究中,對10名患有慢性TBI的人進行了近紅外線TLLLT(810nm)的10次治療,目睹了頭痛、認知功能障礙、睡眠問題、焦慮症、憂鬱症和煩躁症的減輕[151]。 也有一些案例研究表明經顱tLLLT對TBI患者有益[152,153]: “在汽車事故的TBI發生七年後,病例1(一名66歲的婦女)開始進行經顱tLLLT療法。在進行tLLLT治療之前,她只能專注於自己的電腦20分鐘。在每週進行八次tLLLT治療後,她能專心於電腦的時間增加到3個小時。她每晚在家中自我治療已經5.5年,並且在72歲時保持了認知能力的提高。” “案例2(一名52歲退休,高級軍官)曾有多起頭部閉合受傷的歷史。在開始tLLLT治療之前,她因身體殘疾而無法接受治療5個月。在家裡進行了四個月tLLLT夜間治療之後,她回到一家國際技術諮詢公司擔任全職工作,擔任執行顧問,並終止了醫療殘障。經顱tLLLT治療9個月後進行的神經心理學測試顯示,認知和記憶能力顯著改善,創傷後壓力障礙症狀也有所減輕。” “病例3在兩個月內接受了20次tLLLT治療,並獲得了非常有利的結果,憂鬱症,焦慮症,頭痛和失眠症減少,而認知和生活質量得到改善。” tLLLT可以提高認知度,降低TBI治療費用並可以在家中使用嗎?答案是肯定的。這聽起來有點像是藥廠或醫療診所不希望人們知道的事情,這有可能會迫使他們失去許多終身的客戶。 幾項小鼠研究還表明,經顱tLLLT可以預防TBI後的細胞死亡並提高神經功能[154~157]。研究人員認為tLLLT對於那些患有TBI症狀的人來說效果很好,因為TBI後大腦中的粒線體功能異常嚴重,導致ATP的供應不足,tLLLT可以支持粒線體並增加ATP的產生[158~161]。 頭部受傷後,大腦的血液流動和氧合(oxygenation)也很差,發炎和氧化壓力增加。這會造成腦損傷,但是tLLLT可以幫助解決這些問題,增加抗氧化劑,促進神經生成並緩解慢性症狀[162~168]。 阿茲海默症和認知障礙: tLLLT可以提高老年人、年輕健康的人和動物的表現並改善其認知功能,包括注意力和記憶力。 tLLLT可以通過減少與癡呆症相關的大腦蛋白質來減緩阿茲海默症的進展[169~172]。腦源性神經營養因子(BDNF)的下調發生在阿茲海默症的早期階段,並且tLLLT已被證明可通過上調BDNF來防止腦細胞損失[173])。 德克薩斯州奧斯汀大學的Francisco Gonzalez-Lima博士說“tLLLT可以用作對存在阿茲海默症,輕度認知障礙或頭部外傷史的危險因素的人進行預防性干預。在這類患者中,tLLLT可以與認知干預方法相結合。” 研究人員還將tLLLT應用於中年小鼠,發現中年小鼠的記憶力和認知能力得到了很大的提高,可以與年輕小鼠相媲美。研究人員得出結論,tLLLT應該“應用於老年人的一般性認知障礙病例”[18,174]。其他幾項研究表明,tLLLT可以顯著提高警覺性、意識和持續的專注力,並改善短期記憶和反應時間。研究參與者在任務和測試過程中所犯的錯誤也更少[175~179]。另一項研究發現,tLLLT可以通過提供神經保護和支持粒線體來與增強認知能力一樣有效 [180、181])。 中風: 多項研究表明,tLLLT可以顯著減少中風後的腦損傷並改善恢復結果[182~185]。在一項研究中,研究人員在中風後約18小時將tLLLT應用於中風患者頭部的整個表面。中風後五天,他們發現tLLLT治療組的病情明顯改善。中風後90天繼續改善。在研究結束時,接受真正tLLLT治療的患者中有70%的患者取得了成功的結果,而對照組的這一比例僅為51% [186]。 對超過600名中風患者的追蹤研究發現了相似的有益結果。研究人員認為,ATP產量的增加是造成這種改善的原因[187~189]。大量的研究還表明,tLLLT可顯著減少中風後大鼠和兔子的神經系統疾病並改善其行為。它還增加了這些動物中新腦細胞的生長,從而改善了它們的整體恢復能力[190~196]。 其他疾病: tLLLT治療還可以改善許多其他疾病: •帕金森氏症(PD):PD組織中的粒線體受到損害,tLLLT可以開發為改善PD患者神經元功能的新療法[197]。 •肌萎縮性側索硬化症(Amyotrophic lateral sclerosis ; ALS):粒線體功能障礙和氧化壓力在ALS運動神經元喪失中起重要作用。tLLLT組在疾病早期運動功能明顯改善[198]。 •自閉症:與粒線體功能障礙和發炎有關,因此tLLLT可能會有所幫助[199,200]。 •躁鬱症:與粒線體功能障礙和發炎有關[201~203] •精神分裂症:關聯的粒線體功能障礙和發炎[201,202] •酒癮[204,205] •鴉片類藥物成癮[205] •頭痛和偏頭痛[206] 請務必注意,少數人在使用tLLLT初期會感到昏昏欲睡和疲勞。如果是這種情形,請稍事休息,並縮短使用時間及降低光的輸出功率。 結論: 已有大量的臨床實驗證實屬於能量醫學一環的紅光LLLT對於解決廣泛的健康問題有顯著的效果,紅光LLLT對減輕癌症化療的副作用[207]及解決代謝相關問題的臨床研究也正如火如荼的進行中。其中,我最感興趣的研究範疇是紅光LLLT療法與中醫的經絡穴道系統或阿育吠陀脈輪系統互相結合的治療方式。光是一種電磁能量,而共振是電磁能量傳遞最快速有效的方式,所以當紅光LLLT療法與中醫的經絡穴道系統或阿育吠陀脈輪系統相結合,並進一步改良成為可隨時穿戴使用並可即時提供生理資訊回饋等功能,其治療的範圍,可以被合理地認為是全身性的而非只有光照射的區域。 參考文獻 [1] Austin, Prof. Dr. Francisco Gonzalez-Lima The University of Texas at. "Dose-Response Effects of Low-Level Light Therapy on Brain and Muscle." The 13th Annual International Conference on Dose-Response (2014).Austin, Prof. Dr. Francisco Gonzalez-Lima The University of Texas at. "Dose-Response Effects of Low-Level Light Therapy on Brain and Muscle." The 13th Annual International Conference on Dose-Response (2014). [2] http://www.ncbi.nlm.nih.gov/pubmed/5098661 [3] http://www.ncbi.nlm.nih.gov/pubmed/4659882 [4] https://www.psio.com/pdf/TLLLT-of-eye-and-brain.pdf [5] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2442599/ [6]AnneLjunggren1, Jan MBjordal1ChristianCouppé2Roberta TChow3JanTunér4Elisabeth. "A Systematic Review of Low Level Laser Therapy with Location-Specific Doses for Pain from Chronic Joint Disorders." Australian Journal of Physiotherapy (2003). [7] https://www.ncbi.nlm.nih.gov/pubmed/26535475 [8] https://www.ncbi.nlm.nih.gov/pubmed/26347062 [9] https://www.ncbi.nlm.nih.gov/pubmed/24568233 [10] https://www.ncbi.nlm.nih.gov/pubmed/21182447 [11] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2796659/ [12] http://stroke.ahajournals.org/content/40/4/1359.long [13] https://www.ncbi.nlm.nih.gov/pubmed/17463313 [14] http://www.ncbi.nlm.nih.gov/pubmed/19837048 [15] http://www.sciencedirect.com/science/article/pii/S0006295213007417 [16] http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3945284/ [17] http://www.ncbi.nlm.nih.gov/pubmed/21274733 [18] http://www.ncbi.nlm.nih.gov/pubmed/22850314 [19] http://www.ncbi.nlm.nih.gov/pubmed/9421973 [20] http://www.ncbi.nlm.nih.gov/pubmed/11959421 [21] http://www.ncbi.nlm.nih.gov/pubmed/17603858 [22] http://www.ncbi.nlm.nih.gov/pubmed/10365442/ [23] http://www.ncbi.nlm.nih.gov/pubmed/6479342/ [24] http://www.ncbi.nlm.nih.gov/pubmed/2476986/ [25] http://www.ncbi.nlm.nih.gov/pubmed/17463313/ [26] http://www.ncbi.nlm.nih.gov/pubmed/19837048/ [27] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3288797/ [28] http://www.ncbi.nlm.nih.gov/pubmed/23239434?dopt=AbstractPlus [29] http://www.ncbi.nlm.nih.gov/pubmed/6200808 [30] http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3288797/ [31] http://www.isabelleverbeek.nl/wp-content/uploads/2014/05/A2-cognitie-Gonzalez-softlaser-fotonen-therapie-2014b.pdf [32] http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3953713/ [33] http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3065857/ [34] J.C. Sutherland, Biological effects of polychromatic light, Photochem Photobiol 76 (2002) 164-70. [35] Theodore A Henderson and Larry D Morries, Near-infrared photonic energy penetration: can infrared phototherapy effectively reach the human brain? Neuropsychiatr Dis Treat. 2015; 11: 2191–2208. [36] Theodore A. Henderson, Multi-watt near-infrared light therapy as a neuroregenerative treatment for traumatic brain injury, Neural Regen Res. 2016 Apr; 11(4): 563–565. [37] Peterson P.S., Lei X, Wolf RM. CTRP7 deletion attenuates obesity-linked glucose intolerance, adipose tissue inflammation, and hepatic stress. American Journal of Physiology. Feb 2017;10:1152. [38] Caruso-Davis MK, Guillot TS, Podichetty VK, Mashtalir N, Dhurandhar NV, Dubuisson O, Yu Y. Efficacy of low-level laser therapy for body contouring and spot fat reduction. Obes Surg. 2011. Jun;21(6):722-9. [39] Sene-Fiorese M, Duarte FO, et al. The potential of phototherapy to reduce body fat, insulin resistance and "metabolic inflexibility" related to obesity in women undergoing weight loss treatment. Lasers Surg Med. 2015 Oct;47(8):634-42. [40] da Silveira Campos RM, Dâmaso AR, et al. The effects of exercise training associated with low-level laser therapy on biomarkers of adipose tissue transdifferentiation in obese women. Lasers in Medical Science. 2018 Aug;33(6):1245-1254. [41] Avci P, et al, Low-level laser (light) therapy (LLLT) for treatment of hair loss. Lasers Surg Med. 2014 Feb;46(2):144-51. [42] Darwin E, et al, Low-level laser therapy for the treatment of androgenic alopecia: a review. Lasers Med Sci. 2018 Feb;33(2):425-434. [43] Zarei M, et al, Low level laser therapy and hair regrowth: an evidence-based review, Lasers Med Sci. 2016 Feb;31(2):363-71. [44] Chih-Kuang Chen, et al, Effectiveness of Laser Acupuncture in Alleviating Chronic Insomnia: A Single-Blinded Randomized Controlled Trial, Evidence-Based Complementary and Alternative Medicine Volume 2019, Article ID 8136967, 9 pages, https://doi.org/10.1155/2019/8136967 [45] Saltmarche AE, et al, Significant Improvement in Cognition in Mild to Moderately Severe Dementia Cases Treated with Transcranial Plus Intranasal Photobiomodulation: Case Series Report. Photomed Laser Surg. 2017 Aug;35(8):432-441. [46] F. Gonzalez-Lima and Douglas W. Barrett, Augmentation of cognitive brain functions with transcranial lasers, Front Syst Neurosci. 2014; 8: 36. [47] Michael R Hamblin, Mechanisms and applications of the anti-inflammatory effects of photobiomodulation, AIMS Biophys. 2017; 4(3): 337–361. [48] Rojas JC, et al., Low-level light therapy improves cortical metabolic capacity and memory retention. J Alzheimers Dis. 2012;32(3):741-52. [49] Di Hu, Shuyu Zhu, and Jason Robert Potas, Red LED photobiomodulation reduces pain hypersensitivity and improves sensorimotor function following mild T10 hemicontusion spinal cord injury, J Neuroinflammation. 2016; 13(1): 200. [50] https://www.degruyter.com/view/j/plm.2012.1.issue-4/plm-2012-0032/plm-2012-0032.xml [51] Sergey Vladimirovich Moskvin , Oleg Ivanovich Apolikhin, Effectiveness of low level laser therapy for treating male infertility BioMedicine (ISSN 2211-8039) June 2018, Vol. 8, No. 2, Article 7, Pages 1-15 [52] José Carlos Tatmatsu Rocha, et al, Low-Level Laser Therapy (904nm) Can Increase Collagen and Reduce Oxidative and Nitrosative Stress in Diabetic Wounded Mouse Skin, J Photochem Photobiol B. 2016 Nov; 164: 96–102. [53] D.A. Rogatkin , A.V. Dunaev, Stimulation of Blood Microcirculation at Low Level Laser Therapy: Monitoring Tools and Preliminary Data, Journal of Medical Research and Development (JMRD) Jan. 2014, Vol. 3 Iss. 1, PP. 100-106 [54] L.F. De Freitas, M.R. Hamblin, Proposed mechanisms of photobiomodulation or low-level light therapy, IEEE J. Sel. Top. Quantum Electron. 22 (2016) 7000417. [55] N. Lane, Cell biology: power games, Nature 443 (2006) 901–903. [56] Mintzopoulos D, Gillis TE, Tedford CE, Kaufman MJ, Effects of Near-Infrared Light on Cerebral Bioenergetics Measured with Phosphorus Magnetic Resonance Spectroscopy. Photomed. Laser Surg 2017, 35, 395–400. [57] Ando T et al., Comparison of Therapeutic Effects between Pulsed and Continuous Wave 810-nm Wavelength Laser Irradiation for Traumatic Brain Injury in Mice. PLoS ONE 2011, 6, e26212–e26220. [58] Salehpour F et al., Transcranial low-level laser therapy improves brain mitochondrial function and cognitive impairment in D-galactose–induced aging mice. Neurobiol. Aging 2017, 58, 140–150. [59] Kann O, The interneuron energy hypothesis: Implications for brain disease. Neurobiol. Dis 2016, 90, 75–85. [60] Cao X et al., Astrocyte-derived ATP modulates depressive-like behaviors. Nat. Med 2013, 19, 773–777. [61] Lyons DN et al., A Mild Traumatic Brain Injury in Mice Produces Lasting Deficits in Brain Metabolism. J. Neurotrauma 2018, 35, 2435–2447. [62] Briston T; Hicks AR, Mitochondrial dysfunction and neurodegenerative proteinopathies: Mechanisms and prospects for therapeutic intervention. Biochem. Soc. Trans 2018, 46, 829–842. [63] Swerdlow RH, Burns JM, Khan SM, The Alzheimer’s disease mitochondrial cascade hypothesis: Progress and perspectives. Biochim. Biophys. Acta 2014, 1842, 1219–1231. [64] G.B. Waypa, K.A. Smith, P.T. Schumacker, O2 sensing, mitochondria and ROS signaling: the fog is lifting, Mol. Asp. Med. 47-48 (2016) 76–89. [65] Y. Zhao, P.M. Vanhoutte, S.W. Leung, Vascular nitric oxide: beyond eNOS, J. Pharmacol. Sci. 129 (2015) 83–94. [66]Wang X et al., Interplay between up-regulation of cytochrome-coxidase and hemoglobin oxygenation induced by near-infrared laser. Sci. Rep 2016, 6, 30540. [67]Lee HI et al., Pretreatment with light-emitting diode therapy reduces ischemic brain injury in mice through endothelial nitric oxide synthase-dependent mechanisms. Biochem. Biophys. Res. Commun 2017, 486, 945–950. [68]Charriaut-Marlangue C et al., Nitric oxide signaling in the brain: A new target for inhaled nitric oxide? Ann. Neurol 2013, 73, 442–448. [69]Kisler K, Nelson AR, Montagne A, Zlokovic BV, Cerebral blood flow regulation and neurovascular dysfunction in Alzheimer disease. Nat. Rev. Neurosci 2017, 18, 419–434. [70] M.D. Skopin, S.C. Molitor, Effects of near-infrared laser exposure in a cellular model of wound healing, Photodermatol. Photoimmunol. Photomed. 25 (2009) 75–80. [71] D.W. Barrett, F. Gonzalez-Lima, Transcranial infrared laser stimulation produces beneficial cognitive and emotional effects in humans, Neuroscience 230 (2013) 13–23. [72] G. Dougal, S.Y. Lee, Evaluation of the efficacy of low-level light therapy using 1072 nm infrared light for the treatment of herpes simplex labialis, Clin. Exp. Dermatol. 38 (2013) 713–718. [73] F. Vatansever, M.R. Hamblin, Far infrared radiation (FIR): its biological effects and medical applications, Photonics Lasers Med. 4 (2012) 255–266. [74] E. Palazzo, F. Rossi, V. de Novellis, S. Maione, Endogenous modulators of TRP channels, Curr. Top. Med. Chem. 13 (2013) 398–407. [75] R. Planells-Cases et al., Complex regulation of TRPV1 and related thermo-TRPs: implications for therapeutic intervention, Adv. Exp. Med. Biol. 704 (2011) 491–515. [76] M.J. Caterina, Transient receptor potential ion channels as participants in thermosensation and thermoregulation, Am. J. Physiol. Regul. Integr. Comp. Physiol. 292 (2007) R64–R76. [77] P. Cassano, S.R. Petrie, M.R. Hamblin, T.A. Henderson, D.V. Iosifescu, Review of transcranial photobiomodulation for major depressive disorder: targeting brain metabolism, inflammation, oxidative stress, and neurogenesis, Neurophotonics 3 (2016) 031404. [78] F. Tian, S.N. Hase, F. Gonzalez-Lima, H. Liu, Transcranial laser stimulation improves human cerebral oxygenation, Lasers Surg. Med. 48 (2016) 343–349. [79] T. Ando, W. Xuan, T. Xu, T. Dai, S.K. Sharma, G.B. Kharkwal, Y.Y. Huang, Q. Wu, M.J. Whalen, S. Sato, M. Obara, M.R. Hamblin, Comparison of therapeutic effects between pulsed and continuous wave 810-nm wavelength laser irradiation for traumatic brain injury in mice, PLoS One 6 (2011), e26212. [80] Zhang L; Zhang Y; Xing D LPLI inhibits apoptosis upstream of Bax translocation via a GSK-3betainactivation mechanism. J. Cell. Physiol 2010, 224, 218–228. [81] Ling Q; Meng C; Chen Q; Xing D Activated ERK/FOXM1 pathway by low-power laser irradiation inhibits UVB-induced senescence through down-regulating p21 expression. J. Cell. Physiol 2014, 229, 108–116. [82] Eells JT; Gopalakrishnan S; Valter K Near-Infrared Photobiomodulation in Retinal Injury and Disease. Adv. Exp. Med. Biol 2016, 854, 437–441. [83] Eells JT; Henry MM; Summerfelt P; Wong-Riley MTT; Buchmann EV; Kane M; Whelan NT; Whelan HT Therapeutic photobiomodulation for methanol-induced retinal toxicity. Proc. Natl. Acad. Sci. USA2003, 100, 3439–3444. [84] Huang YY; Nagata K; Tedford CE; McCarthy T; Hamblin MR Low-level laser therapy (LLLT) reduces oxidative stress in primary cortical neurons in vitro. J. Biophotonics 2013, 6, 829–838. [85] Sharma SK; Kharkwal GB; Sajo M; Huang Y-Y; De Taboada L; McCarthy T; Hamblin MR Dose Response Effects of 810 nm Laser Light on Mouse Primary Cortical Neurons. Lasers Surg. Med 2011, 43, 851–859. [86] Huang YY; Nagata K; Tedford CE; Hamblin MR Low-level laser therapy (810 nm) protects primary cortical neurons against excitotoxicity in vitro. J. Biophotonics 2014, 7, 656–664. [87] Roomruangwong C et al., A neuroimmune, neuro-oxidative and neuro-nitrosative model of prenatal and postpartum depression. Prog. Neuro-Psychopharmacol. Boil. Psychiatry 2018, 81, 262–274. [88] Rodríguez-Rodríguez A et al., Oxidative Stress in Traumatic Brain Injury. Curr. Med. Chem 2014, 21, 1201–1211. [89] Wu J et al., The Role of Oxidative Stress and Inflammation in Cardiovascular Aging. BioMed Res. Int 2014, 2014, 615312. [90] Wang X et al., Oxidative stress and mitochondrial dysfunction in Alzheimer’s disease. Biochim. Biophys. Acta 2014, 1842, 1240–1247. [91] Steinhubl SR Why Have Antioxidants Failed in Clinical Trials? Am. J. Cardiol 2008, 101, S14–S19. [92] Rahal A et al., Oxidative Stress, Prooxidants, and Antioxidants: The Interplay. BioMed Res. Int 2014, 2014, 761264. [93] Ristow M et al., Antioxidants prevent health-promoting effects of physical exercise in humans. Proc. Natl. Acad. Sci. USA 2009, 106, 8665–8670. [94] Salehpour F; Farajdokht F; Erfani M; Sadigh-Eteghad S; Shotorbani SS; Karimi P; Rasta SH; Mahmoudi J; Hamblin MR Transcranial near-infrared photobiomodulation attenuates memory impairment and hippocampal oxidative stress in sleep-deprived mice. Brain Res 2018, 1682, 36–43. [95] Bartos A et al., Pre-conditioning with near infrared photobiomodulation reduces inflammatory cytokines and markers of oxidative stress in cochlear hair cells. J. Biophotonics 2016, 9, 1125–1135. [96] Mungrue IN; Husain M; Stewart DJ The Role of NOS in Heart Failure: Lessons from Murine Genetic Models. Heart Fail. Rev 2002, 7, 407–422. [97] Assis L; Moretti AI; Abrahao TB; de Souza HP; Hamblin MR; Parizotto NA Low-level laser therapy (808 nm) contributes to muscle regeneration and prevents fibrosis in rat tibialis anterior muscle after cryolesion. Lasers Med. Sci 2013, 28, 947–955. [98] Cury V et al., Low level laser therapy increases angiogenesis in a model of ischemic skin flap in rats mediated by VEGF, HIF-1alpha and MMP-2. J. Photochem. Photobiol. B Boil 2013, 125, 164–170. [99] Walski T; Drohomirecka A; Bujok J; Czerski A; Wąż G; Trochanowska-Pauk N; Gorczykowski M; Cichon R; Komorowska M Low-Level Light Therapy Protects Red Blood Cells Against Oxidative Stress and Hemolysis during Extracorporeal Circulation. Front. Physiol 2018, 9, 647. [100] Sarandol A; Sarandol E; Eker SS; Erdinc S; Vatansever E; Kirli S Major depressive disorder is accompanied with oxidative stress: Short-term antidepressant treatment does not alter oxidative–antioxidative systems. Hum. Psychopharmacol. Clin. Exp 2007, 22, 67–73. [101] Chen Z; Zhong C Oxidative stress in Alzheimer’s disease. Neurosci. Bull 2014, 30, 271–281. [102] Lim W et al., Modulation of lipopolysaccharide-induced NF-kappaB signaling pathway by 635 nm irradiation via heat shock protein 27 in human gingival fibroblast cells. Photochem. Photobiol 2013, 89, 199–207. [103] Yang Y; Gao L Celecoxib Alleviates Memory Deficits by Downregulation of COX-2 Expression and Upregulation of the BDNF-TrkB Signaling Pathway in a Diabetic Rat Model. J. Mol. Neurosci 2017, 62, 188–198. [104] Chen AC-H et al., Low-Level Laser Therapy Activates NF-kB via Generation of Reactive Oxygen Species in Mouse Embryonic Fibroblasts. PLoS ONE 2011, 6, e22453. [105] Chen AC-H et al., Effects of 810-nm Laser on Murine Bone-Marrow-Derived Dendritic Cells. Photomed. Laser Surg 2011, 29, 383–389. [106] Yamaura M et al., Low level light effects on inflammatory cytokine production by rheumatoid arthritis synoviocytes. Lasers Surg. Med 2009, 41, 282–290. [107] Filiano AJ; Gadani SP; Kipnis J Interactions of innate and adaptive immunity in brain development and function. Brain Res 2015, 1617, 18–27. [108] Orihuela R; McPherson CA; Harry GJ Microglial M1/M2 polarization and metabolic states. Br. J. Pharmacol 2016, 173, 649–665. [109] Fernandes KPS et al, Nunes FD Photobiomodulation with 660-nm and 780-nm laser on activated J774 macrophage-like cells: Effect on M1 inflammatory markers. J. Photochem. Photobiol. B Boil 2015, 153, 344–351. [110] Singer AC et al., Noninvasive 40-Hz light flicker to recruit microglia and reduce amyloid beta load. Nat. Protoc2018, 13, 1850–1868. [111] Bergmann O et al., Adult Neurogenesis in Humans. Cold Spring Harb. Perspect. Biol2015, 7, a018994. [112] Oron A et al., Low-Level Laser Therapy Applied Transcranially to Rats after Induction of Stroke Significantly Reduces Long-Term Neurological Deficits. Stroke 2006, 37, 2620–2624. [113] Xuan W et al., Transcranial low-level laser therapy enhances learning, memory, and neuroprogenitor cells after traumatic brain injury in mice. J. Biomed. Opt 2014, 19, 108003. [114] Yang J; Harte-Hargrove LC; Siao C-J; Marinic T; Clarke R; Ma Q; Jing D; Lafrancois JJ; Bath KG; Mark W; et al. ProBDNF negatively regulates neuronal remodeling, synaptic transmission and synaptic plasticity in hippocampus. Cell Rep 2014, 7, 796–806. [115] Yan X; Liu J; Zhang Z; Li W; Sun S; Zhao J; Dong X; Qian J; Sun H Low-level laser irradiation modulates brain-derived neurotrophic factor mRNA transcription through calcium-dependent activation of the ERK/CREB pathway. Lasers Med. Sci 2017, 32, 169–180. [116] Barbieri R; Contestabile A; Ciardo MG; Forte N; Marte A; Baldelli P; Benfenati F; Onofri F Synapsin I and Synapsin II regulate neurogenesis in the dentate gyrus of adult mice. Oncotarget 2018, 9, 18760–18774. [117] Meng C; He Z; Xing D Low-Level Laser Therapy Rescues Dendrite Atrophy via Upregulating BDNF Expression: Implications for Alzheimer’s Disease. J. Neurosci 2013, 33, 13505–13517. [118] Wang Y; Huang Y-Y; Wang Y; Lyu P; Hamblin MR Photobiomodulation of human adipose-derived stem cells using 810 nm and 980 nm lasers operates via different mechanisms of action. Biochim. Biophys. Acta 2016, 1861, 441–449. [119] Forrest MP; Parnell E; Penzes P Dendritic structural plasticity and neuropsychiatric disease. Nat. Rev. Neurosci 2018, 19, 215–234. [120] Nahum M; Lee H; Merzenich MM Principles of Neuroplasticity-Based Rehabilitation. Pathol. Situat. Dis 2013, 207, 141–171. [121] Kuhn M; Weidenauer A; Pezawas L Neuroplasticity and memory formation in major depressive disorder: An imaging genetics perspective on serotonin and BDNF. Restor. Neurol. Neurosci 2014, 32, 25–49. [122] Felling RJ; Song H Epigenetic mechanisms of neuroplasticity and the implications for stroke recovery. Exp. Neurol 2015, 268, 37–45. [123] Tomaszczyk JC; Green NL; Frasca D; Colella B; Turner GR; Christensen BK; Green RE A. Negative Neuroplasticity in Chronic Traumatic Brain Injury and Implications for Neurorehabilitation. Neuropsychol. Rev 2014, 24, 409–427. [124] Creed M; Pascoli VJ; Luscher C Refining deep brain stimulation to emulate optogenetic treatment of synaptic pathology. Science 2015, 347, 659–664. [125] http://www.ncbi.nlm.nih.gov/pubmed/23003120 [126] http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3065857/ [127] http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3538543/ [128] http://www.ncbi.nlm.nih.gov/pubmed/22275301 [129] http://www.ncbi.nlm.nih.gov/pubmed/17868110 [130] http://www.ncbi.nlm.nih.gov/pubmed/23281261 [131] http://www.ncbi.nlm.nih.gov/pubmed/15954817 [132] http://www.ncbi.nlm.nih.gov/pubmed/19995444/ [133] http://www.medscape.com/viewarticle/775815 [134] http://onlinelibrary.wiley.com/doi/10.1002/lsm.20583/abstract [135] http://www.ncbi.nlm.nih.gov/pubmed/17439348 [136] https://www.ncbi.nlm.nih.gov/pubmed/26817446 [137] http://www.ncbi.nlm.nih.gov/pubmed/26202374 [138] http://www.ncbi.nlm.nih.gov/pubmed/19995444 [139] http://www.ncbi.nlm.nih.gov/pubmed/15025051 [140] http://www.ncbi.nlm.nih.gov/pubmed/10739143 [141] https://www.ncbi.nlm.nih.gov/pubmed/27267860 [142] http://dose-response.org/wp-content/uploads/2014/06/Gonzalez-Lima_2014.pdf [143] https://www.ncbi.nlm.nih.gov/pubmed/23200785 [144] https://www.ncbi.nlm.nih.gov/pubmed/26535475 [145] https://www.ncbi.nlm.nih.gov/pubmed/26347062 [146] https://www.cdc.gov/traumaticbraininjury/pdf/bluebook_factsheet-a.pdf [147] http://www.ncbi.nlm.nih.gov/pubmed/18234750/ [148] https://www.cdc.gov/traumaticbraininjury/pdf/mtbireport-a.pdf [149] http://journals.plos.org/plosone/article?id=10.1371%2Fjournal.pone.0053454 [150] https://www.ncbi.nlm.nih.gov/pubmed/24568233 [151] https://www.ncbi.nlm.nih.gov/pubmed/26347062 [152] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3104287/ [153] https://www.ncbi.nlm.nih.gov/pubmed/26535475 [154] http://www.ncbi.nlm.nih.gov/pubmed/17439348/ [155] http://www.ncbi.nlm.nih.gov/pubmed/19800810/ [156] http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3538543/ [157] http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3397203 [158] http://www.ncbi.nlm.nih.gov/pubmed/11059663 [159] http://www.ncbi.nlm.nih.gov/pubmed/19637966 [160] http://www.ncbi.nlm.nih.gov/pubmed/16120426 [161] http://www.ncbi.nlm.nih.gov/pubmed/17439348/ [162] http://www.ncbi.nlm.nih.gov/pubmed/18501200/ [163] http://www.ncbi.nlm.nih.gov/pubmed/19995444/ [164] http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3397203/ [165] http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3397203/ [166] http://www.ncbi.nlm.nih.gov/pubmed/17439348/ [167] http://www.ncbi.nlm.nih.gov/pubmed/17439348 [168] https://www.researchgate.net/publication/229161498_Transcranial_low_level_laser_light_therapy_for_traumatic_brain_injury [169] http://www.ncbi.nlm.nih.gov/pubmed/18769048/ [170] https://www.researchgate.net/publication/263742704_Low-Level_Laser_Therapy_Ameliorates_Disease_Progression_in_a_Mouse_Model_of_Alzheimer%27s_Disease [171] http://www.ncbi.nlm.nih.gov/pubmed/24994540 [172] http://www.ncbi.nlm.nih.gov/pubmed/24387311 [173] http://www.ncbi.nlm.nih.gov/pubmed/23946409 [174] http://www.ncbi.nlm.nih.gov/pubmed/17855128/ [175] https://www.ncbi.nlm.nih.gov/pubmed/23200785 [176] https://www.ncbi.nlm.nih.gov/pubmed/27080072 [177] https://www.ncbi.nlm.nih.gov/pubmed/26017772 [178] https://www.ncbi.nlm.nih.gov/pubmed/27220529 [179] http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3953713/ [180] http://www.sciencedirect.com/science/article/pii/S1074742707001153 [181] http://www.ncbi.nlm.nih.gov/pubmed/23806754 [182] http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3538543/ [183] http://www.ncbi.nlm.nih.gov/pubmed/19995444 [184] http://www.ncbi.nlm.nih.gov/pubmed/17463313/ [185] http://www.ncbi.nlm.nih.gov/pubmed/19233936/ [186] http://www.ncbi.nlm.nih.gov/pubmed/17463313/ [187] http://www.ncbi.nlm.nih.gov/pubmed/19233936/ [188] http://www.ncbi.nlm.nih.gov/pubmed/20425181/ [189] http://www.ncbi.nlm.nih.gov/pubmed/19837048/ [190] http://www.ncbi.nlm.nih.gov/pubmed/19995444 [191] http://www.ncbi.nlm.nih.gov/pubmed/16946145/ [192] http://www.ncbi.nlm.nih.gov/pubmed/17693028/ [193] http://www.ncbi.nlm.nih.gov/pubmed/17678491/ [194] http://www.ncbi.nlm.nih.gov/pubmed/16444697/ [195] http://www.ncbi.nlm.nih.gov/pubmed/17693028 [196] http://www.ncbi.nlm.nih.gov/pubmed/15155955 [197] http://www.ncbi.nlm.nih.gov/pubmed/19534794/ [198] http://www.ncbi.nlm.nih.gov/pubmed/19143012/ [199] http://www.ucdmc.ucdavis.edu/publish/news/newsroom/8932 [200] http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3554862/ [201] http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0004913 [202] http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3626880/ [203] http://www.ncbi.nlm.nih.gov/pubmed/15674998/ [204] http://www.ncbi.nlm.nih.gov/pubmed/23196997 [205] http://www.ncbi.nlm.nih.gov/pubmed/19995444 [206] http://www.ncbi.nlm.nih.gov/pubmed/12811613 [207] Judith A. E. M. Zecha,Low-level laser therapy/photobiomodulation in the management of side effects of chemoradiation therapy in head and neck cancer: part 2: proposed applications and treatment protocols, Support Care Cancer. 2016 Jun; 24(6): 2793–2805.
0 評論
發表回覆。 |
小編Kissin Wang : 類別封存檔 |


 RSS 訂閱
RSS 訂閱
